
16.03.2021 | Wikímica
¿Cómo se forma la materia? Tipos de enlaces químicos, ejemplos y características
El agua, el aire, las rocas y hasta nosotros mismos estamos compuestos de átomos. Normalmente estas unidades básicas de la materia no vagan por el espacio en soledad, sino que se combinan con otros átomos e interactúan con ellos gracias a los enlaces químicos.
Entender qué son los enlaces químicos nos ayudará a comprender mejor las propiedades de la materia y las reacciones químicas, responsables de cambios químicos que ves en tu día a día.
¿Qué son los enlaces químicos?
Llamamos enlace químico a la fuerza por la que los átomos de un compuesto se mantienen unidos. Se trata de fuerzas electromagnéticas que, como te explicaremos a continuación, dan lugar a diferentes tipos de enlaces químicos.
¿Por qué se forma un enlace químico?
Para saber cómo se forman enlaces químicos, primero tienes que entender qué es un átomo y cómo se comporta.
Un átomo está formado por un núcleo rodeado de electrones, que tienen carga negativa. Al tener cargas opuestas, estas dos partes del átomo se atraen entre ellas. Sin embargo, por esta misma razón los electrones también se ven atraídos hacia los núcleos de otros átomos.
Regla del octeto
Los átomos tienden a formar enlaces químicos porque cuando se unen a otros átomos alcanzan una situación más estable, es decir, la que les supone un consumo de energía menor. Esto ocurre cuando el número de electrones de su último nivel es igual a ocho, lo que se conoce como la regla del octeto. Es cierto que no es una norma que se pueda aplicar a todos los átomos, pero sí a la mayoría.
Para cumplir con la regla del octeto, los átomos pueden ceder electrones, ganarlos o incluso compartirlos con otro átomo. Como resultado, se obtienen varios tipos de enlaces químicos distintos.
Tipos de enlaces químicos: características y propiedades
Los principales tipos de enlaces químicos entre átomos son tres: enlaces iónicos, covalentes y metálicos. Se trata de enlaces fuertes y duraderos, que unen a un átomo con otro átomo o grupo de átomos. El tipo de enlace que se genere influirá fuertemente en las propiedades de los compuestos químicos formados.
- Enlace iónico
Los enlaces iónicos ocurren cuando un átomo gana o pierde electrones. Como resultado de esta transferencia de electrones, se forman iones o, lo que es lo mismo, partículas cargadas. Estos iones pueden tener carga negativa (los conocemos como aniones) o positiva (cationes).
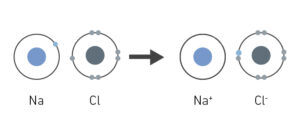
Para explicarte cómo se forma un enlace iónico, veremos algunos ejemplos de enlaces iónicos. Un caso claro es el que se da entre un átomo de cloro (Cl) y uno de sodio (Na) que, como sabes, forman el compuesto químico llamado cloruro de sodio, más conocido como la sal de mesa (NaCl). El sodio solo tiene un electrón mientras que el cloro tiene siete electrones. Por lo tanto, para crear un enlace iónico, el sodio entrega su electrón al cloro, satisfaciendo así la regla del octeto.
Además, al perder un electrón, el átomo de sodio se ha convertido en un catión, con carga positiva, mientras que el cloro, al ganar un electrón, tendrá carga negativa. Al tener cargas opuestas, se atraen intensamente, quedando unidos por un enlace iónico.
Propiedades del enlace iónico
Por lo general, los compuestos de enlaces iónicos forman sólidos cristalinos y se rompen con facilidad. Este es precisamente el caso de la sal de mesa. Además, estos compuestos suelen tener puntos de fusión elevados y son solubles en agua.
Una de las propiedades del enlace iónico más características tiene que ver con la conducción de la electricidad y los estados de la materia. Aunque en estado sólido no son conductores, esto cambia cuando están en estado líquido o en una disolución, debido a los iones móviles.
- Enlace covalente
Otro modo que tienen los átomos para formar enlaces químicos es compartiendo electrones. De esta manera, crean enlaces covalentes. Los electrones no se quedan inmóviles en un punto, sino que se mueven entre los átomos. Esto da lugar a los principales tipos de enlaces covalentes: el enlace covalente polar y el apolar.
En el caso del enlace covalente polar, los átomos comparten electrones de forma no equitativa, lo que significa que estos pasan más tiempo cerca de un átomo que de otro. Por otro lado, en el enlace covalente apolar la repartición de los electrones es más igualitaria.
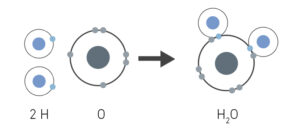
Veamos cómo se forma un enlace covalente al mismo tiempo que conocemos uno de los ejemplos de enlaces covalentes más comunes: el agua. Como sabes el agua es una molécula formada por dos átomos de hidrógeno (H) y uno de oxígeno (O), que da lugar al compuesto químico H2O. En este caso, se forma un enlace covalente porque cada átomo de hidrógeno comparte un electrón con el átomo de oxígeno. A su vez, este último comparte un electrón con cada uno de los átomos de hidrógeno.
Propiedades del enlace covalente
Los compuestos covalentes suelen darse entre elementos similares o no metales. Además, no son buenos conductores de la electricidad.
Los enlaces covalentes permiten que los átomos se agrupen en moléculas y, de hecho, son habituales en las moléculas orgánicas de los organismos vivos, como el ADN.
- Enlace metálico
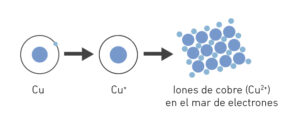
Como dice su nombre, los enlaces metálicos se forman entre átomos de metales. En estos casos los átomos se organizan en una estructura conocida como el mar de electrones.
La estructura del enlace metálico se debe a que los átomos de los metales tienen pocos electrones en la última capa, que pierden fácilmente. Como resultado, se convierten en cationes que se distribuyen por el espacio formando una especie de red, mientras que los electrones que han perdido crean a su alrededor una nube de electrones que puede moverse por toda la red. Así los cationes, con carga positiva, queden unidos mediante la nube de electrones, con carga negativa, que los envuelve.
Los metales son los elementos más abundantes en la tabla periódica, por lo que te será sencillo encontrar ejemplos de enlaces metálicos. Algunos de los más comunes son el hierro, el aluminio o el cobre.
Por ejemplo, un átomo de hierro es simplemente un átomo pero cuando se une con otros átomos del mismo elemento lo hace formando la red de átomos envueltos por electrones de la que te hemos hablado. Es decir, el enlace metálico.
Propiedades del enlace metálico
Esta peculiar estructura en red explica muchas de las propiedades del enlace metálico. Por ejemplo, como los electrones pueden moverse con mucha facilidad, los metales son buenos conductores de la electricidad. También explica la alta maleabilidad y ductilidad de los metales. Otra de las propiedades de los metales más características es su elevado punto de fusión, razón por la que a temperatura ambiente los encontramos en estado sólido.
Enlaces químicos entre moléculas
Durante este artículo te hemos mostrado los principales enlaces químicos entre átomos. Sin embargo, también nos podemos encontrar con otros enlaces químicos entre moléculas. Estos se consideran enlaces temporales, ya que son más débiles. Aun así, son esenciales para la vida porque son los que mantienen unidas a las moléculas. Sin ellos, las encontraríamos dispersas por el ambiente. Es decir, no existiría el estado líquido ni el estado sólido, solo el gaseoso.
A continuación, te mostramos algunos ejemplos de enlaces químicos entre moléculas:
- Puente de hidrógeno
Los enlaces de hidrógeno ocurren cuando el hidrógeno interactúa con otro elemento de alta polaridad. En estos casos, el hidrógeno tiene carga positiva, razón por la cual es atraído hacia los átomos con carga negativa, creando un puente de hidrógeno con ellos.
Aunque este tipo de enlace químico es débil, es muy común. Por ejemplo, son muy habituales los puentes de hidrógeno del agua.
- Fuerzas de dispersión de London
En el caso de las fuerzas de dispersión de London, la unión se puede dar entre cualquier tipo de molécula. Se trata también de enlaces débiles, debidos a desequilibrios temporales en la distribución de los electrones.
Como ya hemos comentado, los electrones siempre están moviéndose por el espacio. Por esta razón, hay momentos en los que se agrupan, creando una carga negativa en una parte de la molécula y una positiva en la otra. Si esta molécula está cerca de otra molécula en la que las cargas eléctricas están desequilibradas, sus cargas opuestas se atraerán entre sí.
¿Por qué es importante conocer los tipos de enlaces químicos?
Ya has visto que los átomos y las moléculas interactúan entre sí de diferentes modos y esto influye en las propiedades de los compuestos químicos que se generan. Conocer los diferentes tipos de enlaces químicos nos ayuda a entender mejor el mundo y a darnos cuenta de que la química tiene un papel indispensable en nuestra vida.


